27. maijā Eiropas Savienības (ES) Oficiālajā Vēstnesī tika publicēta Eiropas Parlamenta un Padomes Regula (ES) Nr. 536/2014 par cilvēkiem paredzētu zāļu klīniskajām pārbaudēm. Regula atceļ Direktīvu 2001/20/EK, kura līdz šim regulēja klīnisko pētījumu jomu ES, tajā skaitā Latvijā, ziņo Zāļu valsts aģentūra (ZVA).
Jaunā Regula stāsies spēkā 20 dienas pēc tās publicēšanas ES Oficiālajā Vēstnesī, un tā tiks piemērota ne agrāk par 2016. gada 28. maiju. Vienu gadu pēc jaunās Regulas piemērošanas būs pārejas periods, kad vienlaikus varēs tikt piemērota gan Direktīva 2001/20/EK, gan Regula.
Salīdzinājumā ar Direktīvu 2001/20/EK Regulā ir noteikts, ka klīnisko pārbaužu pieteicējam/sponsoram būs atvieglota pētījumu pieteikumu dokumentācijas iesniegšana. Visi pieteikumi tiks iesniegti vienā portālā, kas būs jauna ES klīnisko pētījumu datu bāze. Klīnisko pārbaužu pieteikuma izskatīšanas termiņi būs stingri noteikti un vienādi visām dalībvalstīm, kuros būs jāiekļaujas arī to ētikas komitejām. Ja klīnisko pārbaudi būs paredzēts veikt vairāk nekā vienā ES dalībvalstī, starp dalībvalstīm tiks veikta koordinēta klīnisko pārbaužu pieteikuma vērtēšana. Šāda procedūra nodrošinās ātru, kvalitatīvu vērtēšanu un vienotu lēmumu par klīniskās pārbaudes atļaušanu vai neatļaušanu.
Līdz ar jaunās Regulas ieviešanu būs daudz vairāk publiski pieejamas informācijas par klīniskajiem pētījumiem/pārbaudēm, nekā tas ir pašlaik. Turklāt sponsoriem būs jāpublicē visu klīnisko pārbaužu rezultāti. Rezultāti tiks publicēti arī tādā gadījumā, ja tie nebūs pozitīvi.
Regulā ir definēta jauna klīnisko pētījumu kategorija – “maziejaukšanās klīniskā pārbaude”, kam tiks piemēroti daži atvieglojumi, piemēram, klīniskās pārbaudes atļaujas saņemšanai iesniedzamo dokumentu apjoma un monitorēšanas atvieglojumi.
Regulā paredzēts, ka klīniskajā pārbaudē iesaistītās dalībvalstis sadarbosies arī klīnisko pārbaužu drošības vērtēšanā. Regulas ievērošanu dalībvalstīs kontrolēs Eiropas Komisija. Paredzētas arī pārbaudes trešajās valstīs.
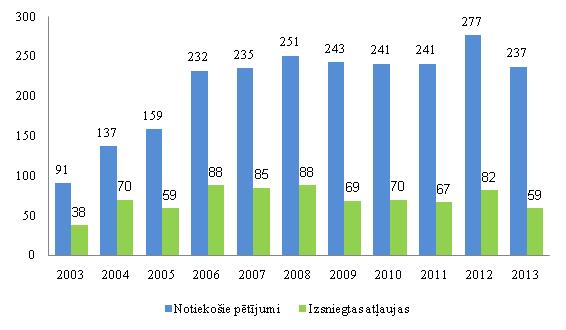
2013. gadā Latvijā noritēja 237 pētījumi. ZVA pērn visvairāk atļaujas izsniedza klīnisko pētījumu veikšanai reimatoloģijā (astoņas), pulmonoloģijā/alergoloģijā (sešas) un endokrinoloģijā (sešas).
Izsniegto atļauju un notiekošo zāļu klīnisko pētījumu skaits (2003.–2013. gads)
www.farmacija-mic.lv
Datu avots: Zāļu valsts aģentūra.

 Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju
Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju