Dzelzs deficīts bez anēmijas ir pietiekami izplatīts. Pacienti var sūdzēties par neizskaidrojamiem, nespecifiskiem simptomiem. Laboratoriski asins parauga izmeklējumi parasti uzrāda zemu feritīna un transferīna piesātinājumu ar normālu hemoglobīna koncentrāciju. Vienmēr jācenšas noteikt un ārstēt patieso dzelzs deficīta cēloni.
Līdz šim gūti ierobežoti pierādījumi par dzelzs ordinēšanu cilvēkiem, kam nav anēmijas. Ja konstatēts dzelzs deficīts, vairumam cilvēku tiek ieteikti perorāli lietojami dzelzi saturoši uztura bagātinātāji. Pēc 60–90 dienu iekšķīgas lietošanas atkārtoti jāveic laboratoriski izmeklējumi. Ja dzelzs deficīts nav novērsts, nepieciešama turpmāka izmeklēšana. Daļai pacientu, kam organisms nav spējis šādā veidā ar dzelzi bagātināties, var sasniegt nepieciešamo dzelzs piesātinājumu intravenozā ceļā.
Dzelzs deficīts ir visizplatītākais minerāla deficīts. Dzelzs deficīta anēmija skar aptuveni 20% iedzīvotāju. Dzelzs deficīts bez anēmijas ir vēl biežāk sastopams (1). Lai gan tas ir trīsreiz biežāk nekā dzelzs deficīta anēmija, dzelzs deficīts bez anēmijas ir nepietiekami pētīta un ārstēta veselības problēma.
Dzelzs deficīts
Pieaugušiem apmēram 70% dzelzs koncentrējas eritrocītu hemoglobīnā, tāpēc anēmija ir visvieglāk noteicamā dzelzs deficīta izpausme. Tomēr mūsu dienās ir skaidrs, ka dzelzs deficītam bez anēmijas arī ir nelabvēlīgas sekas organismā.
Pasaulē pieejama plaša literatūra par dzelzs deficīta anēmiju, bet ir maz kvalitatīvu publikāciju par neanēmisku dzelzs deficītu. Pašreiz pieejamā literatūra galvenokārt balstīta uz nelieliem pētījumiem ar neviendabīgām ļaužu populācijām. Tāpēc trūkst kvalitatīvu vadlīniju, kā veikt izmeklēšanu, ārstēšanu un uzraudzību.
Dzelzs ir viens no būtiskiem elementiem, kas nepieciešams vairākiem vielmaiņas ceļiem un atbild par skābekļa piegādi ķermeņa orgāniem un audiem. Dzelzs deficīts var izraisīt plašu simptomu loku, kas ir nespecifiski un sākumā var netikt saistīti ar dzelzs deficītu.
Dzelzs deficīts bez anēmijas var izpausties šādi:
- nespēks, nogurums, samazinātas darba spējas, grūtības koncentrēties un maza darba produktivitāte;
- neirokognitīvā disfunkcija, arī aizkaitināmība;
- fibromialģijas sindroms;
- tā saucamais nemierīgo kāju sindroms;
- simptomu noturība pacientiem, kam ārstē hipotireozi;
- vājāka neiroloģiskā attīstība zīdaiņiem, kuru mātēm grūtniecības laikā bijis dzelzs deficīts (2).

Dzelzs deficīta diagnostika
Dzelzs deficīts var rasties kā sekundāra veselības problēma nepilnvērtīga uztura dēļ, palielinātas nepieciešamības (piemēram, grūtniecība un zīdīšanas laiks), traucētas uzsūkšanās (piemēram, celiakija, pēc bariatriskas operācijas) vai asins zuduma (piemēram, menstruāciju, asins nodošanas, kuņģa un zarnu trakta asiņošanas) dēļ.
Pacients jāiztaujā par lietotām zālēm, jo īpaši, vai nesen/pašreiz tiek lietoti antikoagulanti, nesteroidālie pretiekaisuma līdzekļi un prettrombocītu līdzekļi. Dzelzs deficīta cēlonis vienmēr rūpīgi jāmeklē un jāārstē.
Laboratoriski izmeklējumi palīdz veikt dzelzs deficīta diferenciāldiagnostiku (sk. 1. tabulu). Pazemināts feritīna līmenis ir visdrošākais sākotnējais marķieris, kas liecina par dzelzs deficītu bez anēmijas. Pasaules Veselības organizācija par zemu feritīna līmeni serumā uzskata tādu rādītāju, kas mazāks par 12 µg/l pieaugušiem. Koncentrācija, kas mazāka par 30 µg/l, norāda uz dzelzs deficīta risku un korelē ar iespējamu dzelzs trūkumu kaulu smadzenēs (sk. 2. tabulu). Dzelzs statusa pārmaiņas vēl pirms anēmijas izveidošanās var konstatēt, veicot pilnu asins ainu, kurā ir mazinājušās vidējā hemoglobīna un vidējā korpuskulārā tilpuma vērtības zem vēlamās normas un palielinājies eritrocītu izkliedes tilpums.
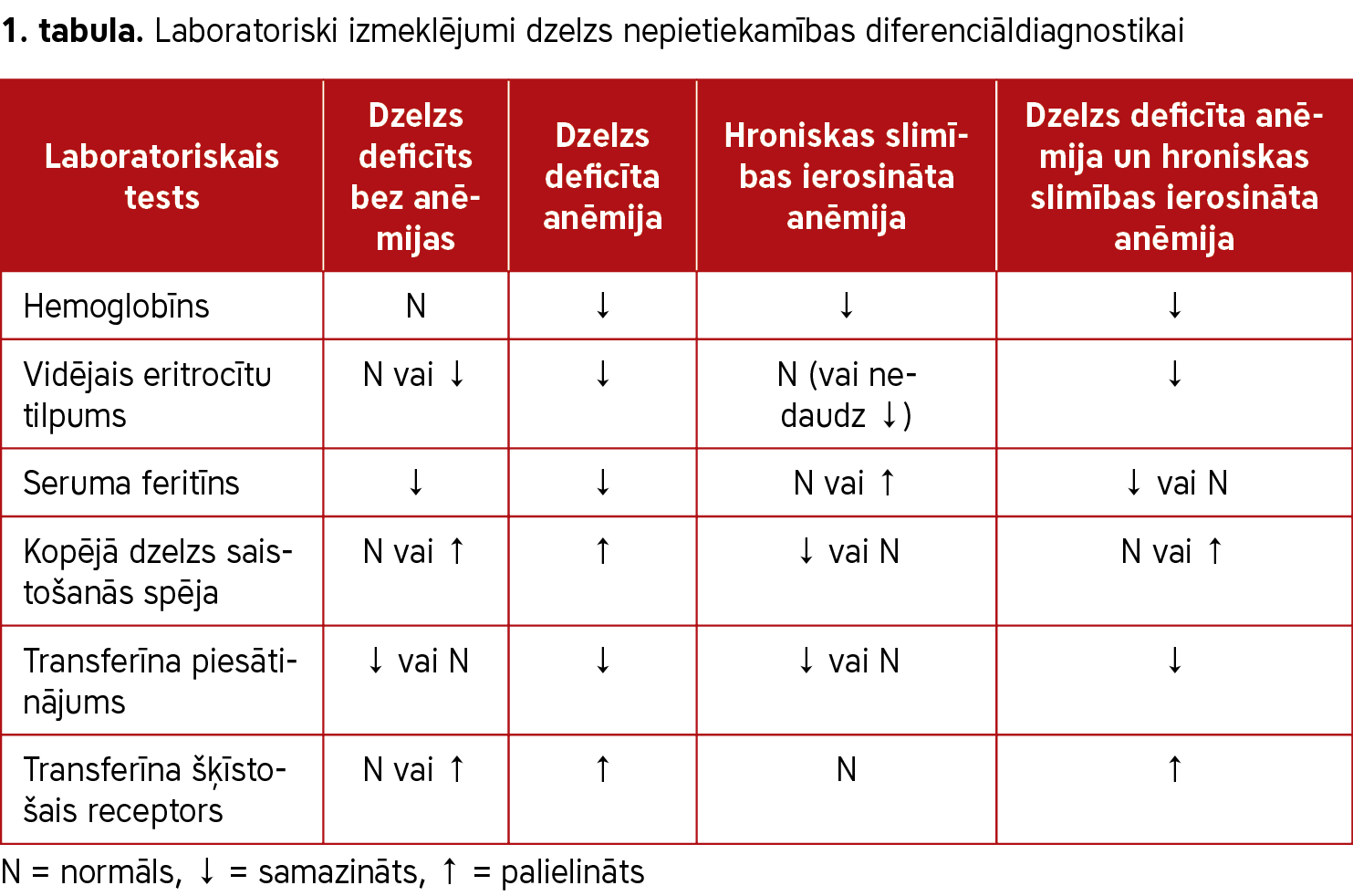

Feritīns ir akūtās fāzes olbaltums, tāpēc tā līmenis organismā paaugstinās iekaisuma laikā un vecākiem cilvēkiem. Tas var apgrūtināt dzelzs deficīta diagnostiku. Šādos gadījumos var izmantot augstāku feritīna slieksni (<100 µg/l) ar zemu transferīna piesātinājumu (<20%).
Lai diagnosticētu dzelzs deficītu pacientiem ar sirds mazspēju, Eiropas Kardiologu biedrība ieteic zemāku feritīna koncentrāciju par 100 µg/l vai zemāku par 300 µg/l, ja transferīna piesātinājums ir mazāks par 20%. Hroniskas nieru slimības gadījumā tiek ieteikts papildus lietot dzelzi, ja feritīna līmenis ir zemāks par 500 µg/l un transferīna piesātinājums mazāks par 30% (3).
Paaugstināta transferīna šķīstošā receptora koncentrācija plazmā ir vēl viens noderīgs bioķīmisks dzelzs deficīta rādītājs, ko var izmantot, lai to atšķirtu no anēmijas kā hroniskas slimības. Dzelzs deficīta diagnostikas zelta standarts ir kaulu smadzeņu biopsija, taču to reti izmanto (4).
Dzelzs deficīta korekcija
Ārstēšanas mērķis ir papildināt dzelzs krājumus organismā un mazināt simptomus. Vispirms kopā ar uztura speciālistu jāizveido atbilstoša ikdienas ēdienkarte un tad jāvērtē, kuri perorālie dzelzi saturoši preparāti būtu labākā izvēle.
Ieguvums no dzelzs papildterapijas dzelzs deficīta gadījumā bez anēmijas fiksēts vairākos nelielos pētījumos un novērojuma pētījumos, galvenokārt piedaloties sievietēm reproduktīvā vecumā un pacientiem ar sirds mazspēju (sk. 3. tabulu).

Neanēmiska dzelzs deficīta ārstēšana ir līdzīga dzelzs deficīta anēmijas ārstēšanai. Jāidentificē un, ja iespējams, jākoriģē problēmas pamatā esošā etioloģija.
Optimālu dzelzs uzņemšanu ar uzturu var panākt, uzņemot hēma dzelzi un brīvo dzelzi. Hēma dzelzs (aknās, sarkanā gaļā, jūras veltēs, mājputnos) labāk absorbējas kuņģa un zarnu traktā, salīdzinot ar brīvo dzelzi (augu valsts izcelme). Veģetārieši var nodrošināt adekvātu dzelzs uzņemšanu, ja uzturā, piemēram, pilngraudu produktos, pākšaugos, riekstos, sēklās, žāvētos augļos un zaļos lapu dārzeņos, tiek patērēts plašs dzelzs daudzums bez hēma, taču šāda diēta bieži nav pietiekama, lai novērstu dzelzs deficītu. Jāvairās no ēdieniem un dzērieniem, kas darbojas par dzelzs uzsūkšanās inhibitoriem (piemēram, tēja, kafija, kakao un sarkanvīns).
Šāda ēdienkarte piemērota asimptomātiskiem pacientiem, kam nav dzelzs vājinātas uzsūkšanās riska.
Dzelzs uzņemšana
Perorāla dzelzs uzņemšana ir pirmās kārtas un drošākā ārstēšana simptomātiskiem pacientiem un pacientiem ar anēmijas risku. Tā ir ērta un izmaksu ziņā pieejama. Parasti tiek ieteikti dzelzs sāļi (fumarāts, sulfāts, glikonāts), jo tie labāk uzsūcas. Vadlīnijas iesaka pacientiem lietot dzelzs preparātus vienu stundu pirms vai divas stundas pēc ēšanas. Dažreiz iespējams panākt kompromisu attiecībā uz devas uzņemšanas laiku, ja tas palīdz ievērot ordinēto terapiju. Lai uzlabotu uzsūkšanos un panesību, kā arī atbalstītu terapijas ievērošanu, dienas devas sadalīšana vairākās reizēs (60–200 mg atkarībā no panesības) ir labāks risinājums par vienreizēju dienas devu (10).
Tomēr jārēķinās, ka pacientam var izpausties nevēlamas kuņģa un zarnu trakta blaknes, piemēram, slikta dūša, sāpes epigastrijā un caureja, kas mēdz izjaukt ārstēšanas kursa ievērošanu. Speciālā literatūrā minēts, ka kontrolētas izdales preparātiem un dzelzs polimaltozes kompleksam retāk izpaužas kuņģa un zarnu trakta nevēlamās blaknes. No otras puses, dzelzs polimaltozes komplekss ir dārgāks par citiem dzelzi saturošiem līdzekļiem, kas ierobežo tā izmantošanu.
Jau sen ieteikts ar dzelzs preparātiem vienlaikus lietot C vitamīnu, lai uzlabotu dzelzs uzsūkšanos. Tomēr nesens pētījums neuzrādīja būtisku atšķirību starp C vitamīna lietotāju un nelietotāju grupām seruma feritīna vidējām rādītājam pēc astoņu nedēļu kursa (11).
Ja pacientam nepieciešama parenterāla dzelzs papildināšana, tiek veikta intravenoza dzelzs ievadīšana, jo intramuskulārai terapijai nav nozīmes. Intravenozi preparāti ir dzelzs karboksimaltoze, derizomaltoze, polimaltoze un saharoze. Intravenoza dzelzs uzņemšana jāierobežo potenciālo blakņu dēļ, to vidū pastāvīgas ādas iekrāsošanās, hipofosfatēmijas un retos gadījumos anafilakses dēļ. No intravenozas dzelzs ievadīšanas jāvairās arī tad, ja pacients sirgst ar aktīvu sistēmisku infekciju, lai izvairītos no riska, ka dzelzs var veicināt mikrobu augšanu un traucēt organisma imūnatbildei.
Galvenās indikācijas intravenozai dzelzs ievadīšanai ir šādas:
- neveiksmīga perorālā terapija – nesasniedz vēlamo rezultātu;
- malabsorbcija (celiakijas, bariatriskās ķirurģijas dēļ);
- iekaisīga zarnu slimība;
- hroniska nieru slimība, kuras dēļ pacients saņem eritropoēzi stimulējošus medikamentus;
- nepieciešama strauja dzelzs daudzuma palielināšana (pirms operācijas, steidzamas operācijas gadījumā vai pēc akūta asins zuduma);
- sirds mazspēja.
Kontrole
Pēc iekšķīgi lietojamu dzelzi saturošu uztura bagātinātāju 60–90 dienu kursa, apmēram nedēļu pēc terapijas pārtraukšanas, būtu jāatkārto laboratoriski izmeklējumi tukšā dūšā, lai pārbaudītu, vai dzelzs deficīts novērsts. Seruma dzelzij raksturīga diennakts mainība, tāpēc vislabākais ir tukšā dūšā no rīta ņemts paraugs pēc tam, kad vismaz 24 stundas pirms testēšanas pārtraukta dzelzs preparāta lietošana. Ja piesātinājums nav sasniegts, ieteicams veikt atkārtotu 60-90 dienu kursu, pēc kura vēlreiz nodod asins paraugu laboratoriskiem izmeklējumiem. Līdzīgi rīkojas intravenozas dzelzs terapijas gadījumā.
Ja nav pozitīvas atbildreakcijas uz perorālo dzelzs terapiju vai dzelzs deficīts atkārtojas, jāapsver turpmāka izmeklēšana, lai izslēgtu asins zudumu slēptas asiņošanas vai malabsorbcijas dēļ. Hemoglobīna koncentrācijas pazemināšanās var būt nozīmīga pat tad, ja pacients nav kļuvis anēmisks. Atkarībā no klīniskās situācijas pacientu vajadzētu nosūtīt pie ginekologa vai gastroenterologa.
Secinājumi
Dzelzs deficīta korekcija vēl pirms anēmijas attīstības var mazināt nevēlamos simptomus un uzlabot pacienta dzīves kvalitāti. Dzelzs deficīta ārstēšanai nepieciešama problēmas identificēšana un tās iemeslu izmeklēšana.
Nekomplicēta dzelzs deficīta gadījumā iekšķīgi lietojamā dzelzs ir viegli pieejama, efektīva, droša, ērta un rentabla terapija. Pacientiem, kas nepanes iekšķīgi lietojamo dzelzi vai cieš no veselības problēmām, kuru gadījumos iekšķīgi lietojamā dzelzs, visticamāk, ir neefektīva vai kaitīga, priekšroka dodama intravenozai ievadīšanai.
Sagatavojusi Iveta Gintere
pēc Balendran S., Forsyth C. Non-anaemic iron deficiency. Aust Prescr., 2021; 44: 193–196.
Vēres
- Kassebaum N. J., Jasrasaria R., Naghavi M., Wulf S. K., Johns N., Lozano R. et al. A systematic analysis of global anemia burden from 1990 to 2010. Blood, 2014; 123: 615–624.
- Goddard A. F., McIntyre A. S., Scott B. B. Guidelines for the management of iron deficiency anaemia. Gut, 2000; 46 Suppl 4: iv1-iv5.
- Pisani A., Riccio E., Sabbatini M., Andreucci M., Del Rio A., Visciano B. Effect of oral liposomal iron versus intravenous iron for treatment of iron deficiency anaemia in CKD patients: a randomized trial. Nephrol Dial Transplant., 2015; 30: 645–652.
- Blunden R. W., Lloyd J. V., Rudzki Z., Kimber R. J. Changes in serum ferritin levels after intravenous iron. Ann Clin Biochem., 1981; 18: 215–217.
- Seid M. H., Derman R. J., Baker J. B., Banach W., Goldberg C., Rogers R. Ferric carboxymaltose injection in the treatment of postpartum iron deficiency anemia: a randomized controlled clinical trial. Am J Obstet Gynecol., 2008; 199: 435. e1–7.
- Bisbe E., Garcia-Erce J. A., Diez-Lobo A. I., Munoz M. Anaemia Working Group Espana. A multicentre comparative study on the efficacy of intravenous ferric carboxymaltose and iron sucrose for correcting preoperative anaemia in patients undergoing major elective surgery. Br J Anaesth 2011; 107: 477–478.
- Anker S. D., Comin Colet J., Filippatos G., Willenheimer R., Dickstein K., Drexler H. et al. FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med., 2009; 361: 2436–2448.
- Kulnigg S., Stoinov S., Simanenkov V., Dudar L. V., Karnafel W., Garcia L. C. et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial. Am J Gastroenterol., 2008; 103: 1182–1192.
- Onken J. E., Bregman D. B., Harrington R. A., Morris D., Buerkert J., Hamerski D. et al. Ferric carboxymaltose in patients with iron-deficiency anemia and impaired renal function: the REPAIR-IDA trial. Nephrol Dial Transplant., 2014; 29: 833–842.
- Gutzwiller F. S., Schwenkglenks M., Blank P. R., Braunhofer P. G., Mori C., Szucs T. D. et al. Health economic assessment of ferric carboxymaltose in patients with iron deficiency and chronic heart failure based on the FAIR-HF trial: an analysis for the UK. Eur J Heart Fail, 2012; 14: 782–790.
- European Medicines Agency. New recommendations to manage risk of allergic reactions with intravenous iron-containing medicines [press release]. 2013 Jun 28.
www.farmacija-mic.lv

 Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju
Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju

