Balsta un kustību aparāta slimības ir galvenais invaliditātes cēlonis visā pasaulē un skar aptuveni 1,71 miljardu cilvēku. Iedzīvotāju skaitam pasaulē strauji pieaugot, aug arī vidējais iedzīvotāju vecums, kas nozīmē, ka palielinās to cilvēku skaits, kuri dzīvo ar balsta un kustību aparāta slimībām un ar tām saistītiem funkcionāliem ierobežojumiem.
Muguras sāpes atzītas par galveno invaliditātes cēloni pasaulē. Balsta un kustību aparāta slimības būtiski ierobežo mobilitāti un veiklību, izraisot nespēju strādāt, pilnvērtīgi baudīt dzīvi un socializēties. Šī patoloģiju grupa ietver vairāk nekā 150 dažādas slimības, kam raksturīgi muskuļu, kaulu, locītavu un saistaudu bojājumi: osteoartrīts, reimatoīdais artrīts, psoriātiskais artrīts, podagra, sarkanā vilkēde, reģionālas sāpes (piemēram, kājās) un vispārējas sāpes (piemēram, fibromialģija), kā arī iekaisumslimības, piemēram, sklerodermija un vaskulīts (1).
Svarīgi palīdzēt uzturēt un atjaunot balsta un kustību aparāta veselību. Lai atvieglotu simptomus, atjaunotu mobilitāti un uzlabotu pacientu dzīves kvalitāti, jānovērš iespējamie cēloņi.
Vairumam cilvēku ar balsta un kustību aparāta slimībām novērojams kolagēna deficīts, kam var būt vairāki iemesli. Ar vecumu dabiskā spēja atjaunot normālu kolagēna līmeni samazinās, kas saistīts ar fibroblastu novecošanos. Kolagēna sintēze samazinās par 1,0–1,5% gadā, sākot no aptuveni 20 gadu vecuma un sasniedz 30%, iestājoties menopauzei. Kolagēna deficīts var rasties arī vairāku slimību dēļ. Piemēram, kolagēna vaskulārās slimības ir slimību grupa, kas izraisa hronisku iekaisumu saistaudos (sarkanā vilkēde, sklerodermija, reimatoīdais artrīts).
Kāpēc kolagēns locītavām ir tik nozīmīgs?
Kolagēns ir olbaltums, kas cilvēka organismā atrodas vislielākā daudzumā, tas ir dažādu saistaudu galvenais struktūrelements. Kolagēnam ir šķiedrai līdzīga struktūra un tas ir galvenā kaulu, ādas, muskuļu, cīpslu un skrimšļu sastāvdaļa. Kopš kolagēna atklāšanas atrasti vairāk nekā 26 jauni kolagēna veidi. Galvenie un visvairāk izpētītie kolagēna veidi ir I, II, III un IV tips, bet kolagēna II tips ir tas, kurš visvairāk atrodams locītavās (2). Tam ir liela nozīme endohondrālā osteoģenēzē, kaulu augšanā un normālā locītavu darbībā (3).
Kolagēna veidi un to ietekme uz locītavām – nedenaturēts II tipa kolagēns pret hidrolizētu kolagēnu
Kolagēns sastāv no aminoskābēm, kas savienotas kopā, veidojot trīskāršu iegarenu fibrilu spirāli, ko sauc par kolagēna spirāli.
UC-II (undenatured type II collagen) – nedenaturēts II tipa kolagēns tiek ražots, izmantojot procesu, kas saglabā tā 3D struktūru. Šī struktūra ir tāda pati kā dabiskam kolagēnam, kas atrodams skrimšļos. UC-II tiek ražots, izmantojot zemas temperatūras procesu, no vistas krūšu kaula skrimšļiem, kas satur daudz II tipa kolagēna. Dabiskam II tipa kolagēnam piemīt īpašs, uz imūnsistēmu vērsts darbības mehānisms, ko sauc par perorālo toleranci – UC-II inhibē iekaisumu un samazina autoimūnās reakcijas pret endogēno kolagēnu locītavu līmenī, t.i., kavē dabiskā kolagēna noārdīšanos (4).
Salīdzinājumam hidrolizēts kolagēns ir kolagēna veids, kas ražošanas gaitā tiek denaturēts un pārtop par dabiskā kolagēna «gabaliem». Hidrolizētais kolagēns satur bioloģiski aktīvus peptīdus, kas spēj ietekmēt locītavu audus un darboties hondroprotektīvi (5), kas ir pilnīgi atšķirīgs darbības mehānisms, salīdzinot ar UC-II tipa kolagēnu.
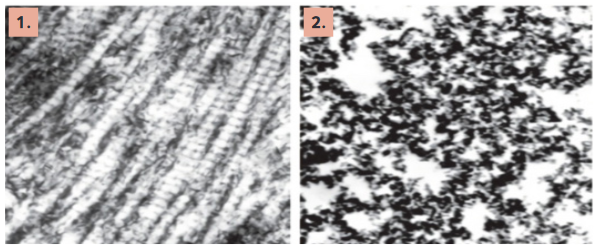
1. attēls. Nedenaturētā (UC-II) un denaturētā II tipa kolagēna elektronmikrogrāfija (4). 1. Da-
biskais II tipa kolagēns (nedenaturēts jeb nehidrolizēts II tipa kolagēns) tā bioloģiski aktīvā
formā. 2. Hidrolizēts jeb denaturēts kolagēns, kas sadalīts mazākās peptīdu molekulās.
UC-II darbības mehānisma skaidrojums
Perorālā tolerance ir imūnprocess, ko organisms izmanto, lai diferencētu nekaitīgus savienojumus (piemēram, uztura olbaltumvielas, zarnu baktērijas) no potenciāli kaitīgām svešām molekulām. Šis process notiek ar zarnām saistītos limfātiskos audos (gut-associated lymphoid tissues – GALT). GALT galvenokārt sastāv no mezenteriskiem limfmezgliem un limfoīdo audu plāksnītēm, kas atrodas tievās zarnās (Peijera plāksnītes). Peijera plāksnītes atpazīst savienojumus zarnu lūmenā un atkarībā no savienojuma ieslēdz vai izslēdz organisma imūnreakciju. UC-II mijiedarbojas ar Peijera plāksnītēm, kur tas aktivizē imūnšūnas. Tas pārveido naivās T šūnas par T regulējošām (Treg) šūnām, kas īpaši vērstas uz II tipa kolagēnu. Treg šūnas nonāk cirkulācijā un atpazīst II tipa kolagēnu locītavu skrimšļos, Treg šūnas izdala pretiekaisuma mediatorus (citokīnus), tostarp transformējošo augšanas faktoru-bēta (TGF-beta), interleikīnu 4 (IL-4) un interleikīnu 10 (IL-10). Pateicoties šim procesam, mazinās iekaisums locītavās un tiek veicināta skrimšļa atjaunošanās.
Klīniski apstiprināti laboratorijas testi apliecina, ka UC-II aktīvie epitopi ir izturīgi pret gremošanas procesiem un saglabā nedenaturēto 3D struktūru, kas nepieciešama, lai veicinātu perorālo toleranci, kura iedarbina pretiekaisuma un skrimšļa aizsardzību, vienlaikus veicinot skrimšļa atjaunošanos un reģenerāciju (4).
UC-II klīnisko pētījumu kopsavilkums
Klīniskos pētījumos, kuros tika vērtēta dabiskā II tipa kolagēna lietošana veseliem cilvēkiem ar locītavu diskomfortu, senioriem, kā arī pacientiem ar osteoartītu, tika novēroti statistiski ticami, pozitīvi rezultāti locītavu sāpju mazināšanā un to funkciju uzlabošanā.
1. Randomizēta, dubultmaskēta, placebo kontrolēta, paralēlu grupu 12 nedēļu pētījuma ar dabisko II tipa kolagēnu 58 dalībiekiem Japānā1 rezultāti liecina, ka nedenaturēts II tipa kolagēns ir drošs un efektīvs, lai uzlabotu ceļa locītavas elastību un mobilitāti, mazinātu sāpes ceļgalos un muguras lejasdaļā, kā arī uzlabotu locītavu motorisko funkciju (6).
2. Randomizētā, dubultmaskētā, placebo kontrolētā pētījumā Vācijā2 96 veseliem indivīdiem ar fiziskas slodzes izraisītu locītavu diskomfortu natīvais II tipa kolagēns 40 mg devā 24 nedēļu laikā ievērojami uzlaboja ceļa locītavu kustīgumu un fleksibilitāti, pie tam lielākas izmaiņas tika novērotas par 35 gadiem vecākiem indivīdiem (7).
3. Salīdzinošā, prospektīvā pētījumā 53 sievietēm vecumā no 60 līdz 80 gadiem ar osteoartīta diagnozi Brazīlijā3 II tipa natīvā kolagēna 3 mēnešu lietošanas laikā uzlabojās dzīves kvalitātes, sāpju vizuālās skalas, rīta stīvuma un WOMAC rādītāji, salīdzinot
ar kontrolgrupu (8).
4. Randomizētā, dubultmaskētā, placebo kontrolētā, daudzcentru pētījumā 191 pacientam ar ceļa locītavas osteoartrītu ASV4 natīvais II tipa kolagēns 6 mēnešu kursā statistiski ticami samazināja WOMAC skalas rādītāju, salīdzinot ar placebo grupu, pie tam būtiskas izmaiņas tika novērotas visās trīs WOMAC apakšskalās – sāpju, rīta stīvuma un locītavu fizisko funkciju apakšskalā (9).
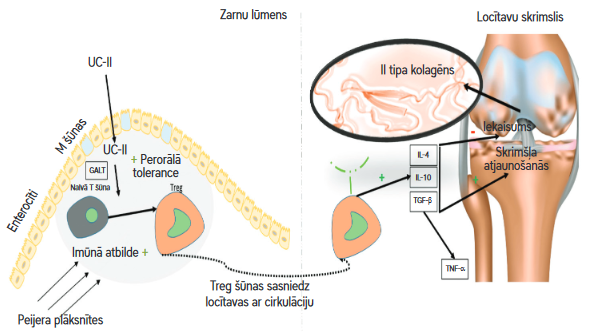
2. attēls. UC-II darbības mehānisms (4)
II tipa kolagēna drošums un efektivitāte
II tipa kolagēnu var lietot ilgstoši, tas ir labi panesams bez izteiktām blaknēm. To nevajadzētu lietot cilvēkiem ar veģetāru vai vegānu diētu, jo tā ieguves avots ir vistas skrimslis. Kolagēna atjaunošana (laiks līdz pirmam efektam) var ilgt no 4 līdz 12 nedēļām, bet labāko rezultātu sasniegšanai, kolagēnu pastāvīgi jālieto vismaz trīs mēnešus.
C vitamīna nozīme kolagēna sintēzē
C vitamīnam ir būtiska nozīme kolagēna veidošanā – pierādīts, ka C vitamīns stabilizē kolagēna mRNS, tādējādi palielinot kolagēna sintēzi. C vitamīna papildu uzņemšana veicina optimāla kolagēna blīvuma uzturēšanu un stiprina esošo kolagēna tīklu (11). Vairāki pētījumi pierāda C vitamīna spēju paātrināt kaulu dzīšanu pēc lūzuma. Nav mazsvarīgi, ka C vitamīna uzņemšana samazina oksidatīvo stresu, neitralizējot reaktīvos skābekļa savienojumus (12). Reaktīvie skābekļa savienojumi (ROS) ir galvenais hroniska iekaisuma cēlonis. Iekaisuma mediatori, piemēram, interleikīns-1β (IL-1β), tumora nekrozes faktors-α (TNF-α) un interleikīns-6 (IL-6), lielākā daudzumā atrasti osteoartrīta skartās locītavās, kur tas izraisa ROS veidošanos, skrimšļa degradāciju un locītavu disfunkciju (13).
Magnija ietekme uz kaulu veselību
Mēs labi zinām, ka magnijs mazina muskuļu sasprindzinājumu, kontrolē muskuļu kontraktilitāti un veicina muskuļu atjaunošanos (piemēram, pēc intensīva treniņa). Magnijs darbojas kā gludo muskuļu relaksants, bloķējot kalcija izraisītas kontrakcijas – samazinot intracelulārā Ca2+, bet nemainot intracelulārā Mg2+ līmeni. Magnijam ir arī izšķiroša nozīme kaulu normālu funkciju uzturēšanā. Magnija deficīts var ietekmēt kaulus tieši (samazinot kaulu blīvumu, palielinot osteoklastu skaitu un samazinot osteoblastu skaitu) un netieši (traucējot D vitamīna, parathormona un kalcija normālu funkciju, veicinot oksidatīvo stresu un sekojošu kaulu zudumu). Magnijs ir būtisks D vitamīna sintēzes un aktivācijas kofaktors. Enzīmi, kas sintezē un metabolizē D vitamīnu, ir atkarīgi no magnija, kas darbojas kā kofaktors enzīmu reakcijās aknās un nierēs (14). Pierādīts, ka zemāks magnija līmenis ir saistīts ar osteoporozi un ka aptuveni 30–40% pētījumā iekļauto personu (galvenokārt sievietēm menopauzes periodā) ir hipomagniēmija. Dažādi uztura pētījumi liecina, ka vairums cilvēku pastāvīgi patērē mazāku magnija daudzumu nekā ieteikts. ASV pieaugušo skaits, kas nesaņem ieteicamo magnija daudzumu uzturā, sasniedz 79%. Papildinot uzturu ar magniju, pacientiem atjaunojas kaulu minerālblīvums un samazinās lūzumu risks (15, 16).
D vitamīna daudzdimensionālie efekti
Pašlaik atzīts, ka D vitamīna deficīts ir ļoti izplatīts (Eiropā līdz 40%), īpaši tādās valstīs kā Latvija, kur saule nespīd pietiekami daudz. Kalcitriols (aktīvā D vitamīna forma) ietekmē muskuļu darbību, regulējot olbaltumu sintēzi, šūnu diferenciāciju un proliferāciju, vienlaikus modulējot fosfolipīdu metabolismu. Fosfolipīdi ir svarīga visu dzīvo būtņu šūnu membrānu sastāvdaļa – regulē membrānas fizikālķīmiskus procesus (ietekmē receptoru, jonu kanālu un transportmolekulu uzbūvi un darbību), kā arī kalpo par prostaglandīnu un citu signālmolekulu prekursoriem.
D vitamīns vairākkārt uzlabo kalcija un fosfāta uzsūkšanos zarnās – tās ir galvenās minerālvielas, kas atrodamas kaulos, kas stiprina kaulus un padara tos cietākus. Papildus to struktūru stiprinošai funkcijai gan kalcijs, gan fosfāts ietekmē osteoklastu un osteoblastu darbību (17, 18). Pētījumu dati liecina, ka D vitamīna deficīts negatīvi ietekmē muskuļu darbību un veicina muskuļu vājumu. Zems D vitamīna līmenis var palielināt osteoporozes un kaulu lūzumu risku.
Jauna cilvēka organismā kaulu masa atjaunojas daudz ātrāk, nekā sadalās vecā kaulu masa, tādējādi kaulu masa pieaug. Vairums cilvēku sasniedz maksimālo kaulu masu aptuveni 30 gadu vecumā. Pēc šī vecuma kaulu remodelācija turpinās, bet mēs zaudējam vairāk kaulu masas, nekā tā atjaunojas. Ar vecumu kauli zaudē būtiskās minerālvielas, tādēļ var notikt lūzumi. Par laimi, stiprus kaulus var saglabāt, lietojot vērtīgas uzturvielas un izvēloties veselīgu dzīvesveidu:
- uzturā lietojot pietiekami daudz olbaltumu;
- ēdot dārzeņus un pārtiku ar augstu magnija, kalcija un D vitamīna saturu;
- veicot spēka vingrinājumus (spēka treniņš palielina muskuļu masu un var palīdzēt aizsargāt pret kaulu zudumu jaunākiem un vecākiem cilvēkiem);
- saglabājot stabilu un veselīgu ķermeņa masu.
Inovācijas locītavu veselībai
Sekojot līdzi nozares tendencēm, Latvijas farmācijas uzņēmums Lotos Pharma sadarbībā ar ortopēdiem ir izstrādājis jaunu produktu MAGNEFlex, kas paredzēts visas locītavas veselībai – skrimšļiem, muskuļiem un kauliem.
MAGNEFlex sastāvā ir jaunākais locītavu II tipa nedenaturēts jeb natīvais kolagēns un magnijs – divas neatņemamas balsta un kustību aparāta veselības pamatvienības. Nedenaturēts II tipa kolagēns ir galvenā locītavu skrimšļa dabiska sastāvdaļa. Magnijs veicina normālu muskuļu darbību. Kombinācija papildināta ar C vitamīnu, kas veicina normālu kolagēna veidošanos, kas nepieciešams normālai skrimšļu un kaulu darbībai. Turklāt sastāvā ir 4000 SV D3 vitamīna, kas palīdz uzturēt kaulu veselību un normālu muskuļu darbību, kā arī B6 vitamīns, kas nodrošina sinerģisku efektu.
MAGNEFlex ieteicams lietot ikdienā ikvienam, kurš rūpējas par savu kaulu un locītavu veselību, un vēlas uzturēt normālu muskuļu darbību.
Uztura bagātinātājs. Uztura bagātinātājs neaizstāj pilnvērtīgu un sabalansētu uzturu.
Vēres
1. Pasaules Veselības Organizācija (WHO). Musculoskeletal health. https://www.who.int/news-room/fact-sheets/detail/musculoskeletal-conditions. Sk. [26/12/2023].
2. Alcaide-Ruggiero L., Molina-Hernández V., Granados M. M., Domínguez J. M. Main and minor types of collagens in the articular cartilage: the role of collagens in repair tissue evaluation in chondral defects. International Journal of Molecular Sciences, 2021, 22 (24), 13329.
3. Gregersen P. A., Savarirayan R. Type II collagen disorders overview. 2019.
4. Gencoglu H., Orhan C., Sahin E., Sahin K. Undenatured type II collagen (UC-II) in joint health and disease: a review on the current knowledge of companion animals. Animals, 2020, 10 (4), 697.
5. Martínez-Puig D., Costa-Larrión E., Rubio-Rodríguez N., Gálvez-Martín P. Collagen supplementation for joint health: the link between composition and scientific knowledge. Nutrients, 2023, 15 (6), 1332.
6. Shiojima Y et al. Journal of the American Nutrition Association, 2023, 42 (3) 224-141.
7. Schon K. et al. Journal of integrative and complementary medicine, 2022, 28 (6) 540–548.
8. Sadigursky D. et al. Acta Ortop Bras. [online]. 2022; 30 (2): 1. http://www.scielo.br/aob.
9. Lugo et al. Nutrition Journal, 2016, 15: 14 DOI 10.1186/s12937-016-0130-8.
10. Xu R., Du Y., Li X., Mao X., Zheng L., Zhao M. Differences between soluble and insoluble undenatured type II collagen in improving osteoarthritis in rats and their potential mechanisms. Food & Function, 2023, 14 (22), 10240-10251.
11. Boyera N., Galey I., Bernard B. A. Effect of vitamin C and its derivatives on collagen synthesis and cross‐linking by normal human fibroblasts. International journal of cosmetic science, 1998, 20 (3), 151-158.
12. DePhillipo N. N., Aman Z. S., Kennedy M. I., Begley J. P., Moatshe G., LaPrade R. F. Efficacy of vitamin C supplementation on collagen synthesis and oxidative stress after musculoskeletal injuries: a systematic review. Orthopaedic journal of sports medicine, 2018, 6 (10), 2325967118804544.
13. Ansari M. Y., Ahmad N., Haqqi T. M. Oxidative stress and inflammation in osteoarthritis pathogenesis: Role of polyphenols. Biomedicine & pharmacotherapy, 2020, 129, 110452.
14. Dai Q., Zhu X., Manson J. E., Song Y., Li X., Franke A. A., Shrubsole M. J. Magnesium status and supplementation influence vitamin D status and metabolism: results from a randomized trial. The American journal of clinical nutrition, 2018, 108 (6), 1249-1258.
15. Rondanelli M., Faliva M. A., Tartara A., Gasparri C., Perna S., Infantino V., Peroni G. An update on magnesium and bone health. Biometals, 2021, 34 (4), 715-736.
16. Groenendijk I., van Delft M., Versloot P., van Loon L. J., de Groot L. C. Impact of magnesium on bone health in older adults: A systematic review and meta-analysis. Bone, 2022, 154, 116233.
17. Dai Q., Zhu X., Manson J. E., Song Y., Li X., Franke A. A., Shrubsole M. J. Magnesium status and supplementation influence vitamin D status and metabolism: results from a randomized trial. The American journal of clinical nutrition, 2018, 108 (6), 1249-1258.
18. Girgis C. M., Clifton‐Bligh R. J., Turner N., Lau S. L., Gunton J. E. Effects of vitamin D in skeletal muscle: falls, strength, athletic performance and insulin sensitivity. Clinical endocrinology, 2014, 80 (2), 169-181.
19. Książek A., Zagrodna A., Słowińska-Lisowska M. Vitamin D, skeletal muscle function and athletic performance in athletes – A narrative review. Nutrients, 2019, 11 (8), 1800.

 Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju
Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju