Metabolisma disfunkcijas izraisīta steatotiskā aknu slimība – MASLD
Nealkohola taukaino aknu slimībai (non-alcoholic fatty liver disease, NAFLD), kuru kopš 2023. gada sauc par metabolisma disfunkcijas izraisītu steatotisko aknu slimību (metabolic dysfunction-associated steatotic liver disease, MASLD), raksturīga lieko tauku uzkrāšanās aknās bez pārmērīgas alkohola lietošanas. Tā skar aptuveni 20–30% iedzīvotāju, un tās izplatība pieaug (1, 2).
MASLD ir cieši saistīta ar insulīnrezistenci, aptaukošanos, metabolisko sindromu un 2. tipa cukura diabētu, un steatotiskās aknu slimības izplatība diabēta slimniekiem pasaulē sasniedz 55,5% (3, 4).
Slimība var progresēt līdz aknu cirozei, hepatocelulārai karcinomai un sirds un asinsvadu sistēmas komplikācijām (3).
Steatotiskās aknu slimības diagnostika rada ievērojamas grūtības, jo bieži norit bez simptomiem, kas noved pie nejaušas atklāšanas paaugstināta transamināžu līmeņa vai hepatomegālijas dēļ (5). Aknu biopsija joprojām ir zelta standarts MASLD diagnostikai un stadijas noteikšanai (6–9). Tomēr aknu biopsija ir saistīta ar risku, jo tā ir invazīva diagnostikas metode (7). Tāpēc kā alternatīvas diagnostikas metodes arvien vairāk tiek attīstītas neinvazīvas metodes, piemēram, ultrasonogrāfija, datortomogrāfija, magnētiskā rezonanse un elastogrāfija (6, 7). Slimības identificēšanai var izmanto arī plazmas aminotransferāzes (ALAT un ASAT), kuru līmenis ir paaugstināts MASLD slimniekiem, īpaši II un III pakāpes steatotiskās aknu slimības gadījumā, savukārt pacientiem ar I pakāpi bieži vien ir normāls aknu enzīmu līmenis (10).
Liekās masas saistība ar steatotisko aknu slimību
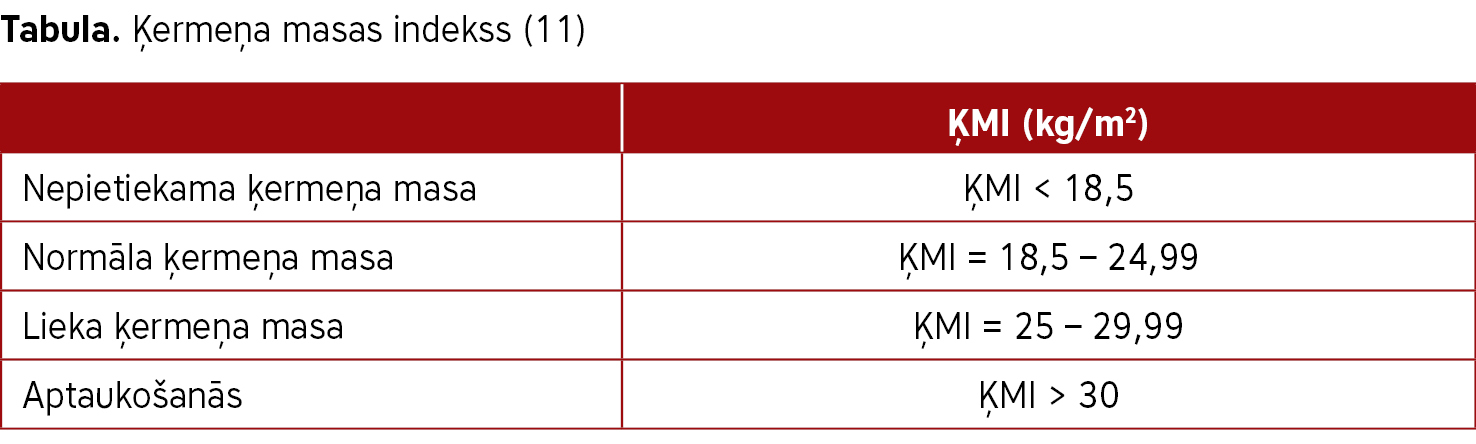
Visbiežāk izmantotā metode liekās ķermeņa masas noteikšanai ir ķermeņa masas indekss (ĶMI), kura novērtēšanai izmanto PVO 1995. gada klasifikāciju četrās kategorijās (sk. tabulu). Izmantojot ĶMI, nosaka ķermeņa masas un auguma garuma proporciju. ĶMI aprēķināšanas formula:
ĶMI = masa (kg) : augums (m)2 (11).
Latvijā 2022. gadā liekās masas un aptaukošanās izplatība iedzīvotājiem vecumā no 16 gadiem pārsniedza Eiropas Savienības vidējo rādītāju (59,2% Latvijā, 50,6% ES), turklāt pēdējo gadu laikā šī tendence turpina pieaugt (12). Metabolisma disfunkcijas izraisīta steatotiskā aknu slimība ir nozīmīga globāla veselības problēma, īpaši cilvēkiem ar lieko masu un aptaukošanos. MASLD skar aptuveni 50,7% pieaugušo ar lieko masu/aptaukošanos visā pasaulē, vīriešiem saslimstība ir augstāka (59%) nekā sievietēm (47,5%) (13).
MASLD patoģenēze ir multifaktoriāla un balstās uz sarežģītu ģenētisko, ar dzīvesveidu saistīto faktoru, zarnu disbiozes, lipotoksicitātes un oksidatīvā stresa mijiedarbību. Papildus aknu bojājumiem MASLD ir saistīta arī ar plašākām sekām, tostarp paaugstinātu risku dažādu metabolisko, sirds un asinsvadu, onkoloģisko un infekcijas slimību attīstībai (14).
Pašlaik visefektīvākās MASLD ārstēšanas metodes ir dzīvesveida maiņa (ietver uztura maiņu), fiziskās aktivitātes palielināšana un liekās masas mazinšana (3, 4).
Hepasan® INTENSE sastāvā esošās aktīvās vielas
Silimarīns
Silimarīns, kas iegūts no mārdadža, cilvēkiem aknu veselību ietekmē dažādos veidos. Silimarīnam piemīt antioksidatīvas, pretiekaisuma un hepatoprotektīvas īpašības, kas var būt labvēlīgas dažādu aknu slimību, tostarp taukaino aknu slimības, gadījumā, kā arī tas var mazināt hepatocelulārās karcinomas risku (15).
Sistematizēts pārskats un metaanalīze par deviņiem klīniskajiem pētījumiem pacientiem ar metabolisma disfunkcijas izraisītu steatotisko aknu slimību atklāja, ka silimarīns būtiski samazina ALAT, ASAT un triglicerīdu līmeni, vienlaikus uzlabojot ABL holesterīna rādītājus; vienā pētījumā tika konstatēta arī fibrozes mazināšanās (16).
Holīns
Holīns ir būtiska uzturviela, kas ir ļoti svarīga šūnu un organisma homeostāzes uzturēšanai, jo veic vairākas fizioloģiskas funkcijas (17). Kā fosfolipīdu un sfingolipīdu galvenā sastāvdaļa holīns ir neaizstājama šūnu membrānas sastāvdaļa un šūnu signalizācijas nodrošinātājs. Tas kalpo kā fosfatidilholīna, acetilholīna (galvenā neirotransmitera) un betaīna (svarīga metilgrupu donora) prekursors (17, 18). Holīna metabolisms cieši saistīts ar metionīna un folātu vielmaiņu (19).
Holīnam ir būtiska nozīme aknu veselības uzturēšanā, un tā deficīts var novest pie taukaino aknu slimības un aknu bojājumiem. Cilvēkiem, kuru uzturā ir maz holīna, attīstās hepatosteatoze un aknu šūnu bojāeja, un paaugstināts ALAT līmenis kalpo par klīnisku aknu bojājuma rādītāju (20, 21). Populācijas pētījumi liecina, ka lielāks holīna patēriņš saistīts ar samazinātu nealkohola taukaino aknu slimības risku, īpaši cilvēkiem ar normālu ķermeņa masu (21, 22).
Pētījumā holīnu saturošam savienojumam fosfatidilholīnam bija terapeitisks efekts pacientiem ar NAFLD. Fosfatidilholīna lietošana trīs mēnešus būtiski mazināja ALAT līmeni par 59,6% un ASAT līmeni par 75,4%, vienlaikus palielinot antioksidatīvo enzīmu aktivitāti (23).
L-metionīns
L-metionīnam un tā metabolītam S-adenozil-L-metionīnam (SAMe) ir svarīga nozīme aknu veselības uzturēšanā, darbojoties caur vairākiem mehānismiem. Metionīns kalpo kā glutationa sintēzes prekursors (galvenā aknu aizsardzības sistēma pret oksidatīvo stresu) un galvenais metilgrupu donors dažādos šūnu procesos (24, 25). Hronisku aknu slimību gadījumā metionīna vielmaiņa ir traucēta, jo samazinās SAMe sintēzes enzīma aktivitāte, kas noved pie metionīna uzkrāšanās un SAMe deficīta (25).
Metionīna vielmaiņas traucējumi var pastiprināt aknu bojājumus, un galvenie enzīmi MAT1A un MAT2B ir cieši saistīti ar fibrozes un hepatocelulārās karcinomas attīstību (24). SAMe papildu lietošanai ir terapeitisks potenciāls tādu slimību gadījumā kā NAFLD un intrahepatiska holestāze, nodrošinot antioksidatīvu aizsardzību un uzlabojot aknu funkciju (25, 26).
Vitamīns B9
B₉ vitamīns (folāti/folskābe) būtiski veicina aknu veselību, darbojoties caur vairākiem mehānismiem. Aknas ir galvenais folātu uzkrāšanas un vielmaiņas centrs, un folāti piedalās vienoglekļa pārneses reakcijās, kas uztur metilēšanas spēju un samazina oksidatīvo stresu. Folātu deficīts var traucēt metilēšanu un veicināt aknu saslimšanu, savukārt pārmērīga folskābes uzņemšana var radīt negatīvu ietekmi uz aknām (27).
B₉ vitamīns ir būtisks metilācijas procesos, kas regulē gan lipīdu, gan glikozes vielmaiņu. B₉ vitamīna deficīts veicina tauku uzkrāšanos aknās un paaugstina lipogēnisko gēnu aktivitāti, savukārt tā papildu uzņemšana var samazināt triglicerīdu līmeni un uzlabot insulīnjutību pacientiem ar 2. tipa cukura diabētu (28–30).
Vitamīns B12
Pētījumi liecina, ka B₁₂ vitamīns var sniegt hepatoprotektīvu ietekmi dažādu aknu bojājumu gadījumā (31).
Dzīvnieku pētījumos B₁₂ vitamīns demonstrēja aizsargājošu efektu pret zāļu izraisītu aknu bojājumu, samazinot aknu enzīmu (ASAT, ALAT) līmeni un inhibējot fibrozes marķierus (alpha-smooth muscle actin and heat-shock protein 47) (31).
Pētījumos cilvēkiem ar NAFLD B₁₂ vitamīna līmenis bieži bija būtiski zemāks nekā kontrolgrupās ar veseliem cilvēkiem (32).
Novērojums: Dabiska preparāta Hepasan® INTENSE ietekme uz aknu enzīmu (ASAT un ALAT) rādītājiem
Novērojuma mērķis un uzdevumi bija novērtēt aknu enzīmu ASAT un ALAT līmeņa pārmaiņas pēc terapijas ar Hepasan® INTENSE, kā arī izvērtēt novērojumā iesaistīto dalībnieku ĶMI.
Novērojuma dalībnieki 2025. gadā četras nedēļas lietoja vienu Hepasan® INTENSE kapsulu dienā, kas atbilst noteiktajai diennakts devai.
Novērojuma galīgajā analīzē iekļauti 197 dalībnieku dati no 48 ģimenes ārstu praksēm Latvijā, vecums no 25 līdz 92 gadiem; 52% dalībnieku bija sievietes un 48% – vīrieši. Novērojumā tika iekļauti nejauši izvēlēti pacienti, kuriem bija paaugstināts aknu enzīmu ASAT un ALAT līmenis (ASAT sievietēm >31 v/l, vīriešiem >37 v/l; ALAT sievietēm >31 v/l, vīriešiem >41 v/l).
Aknu enzīmu rādītāji
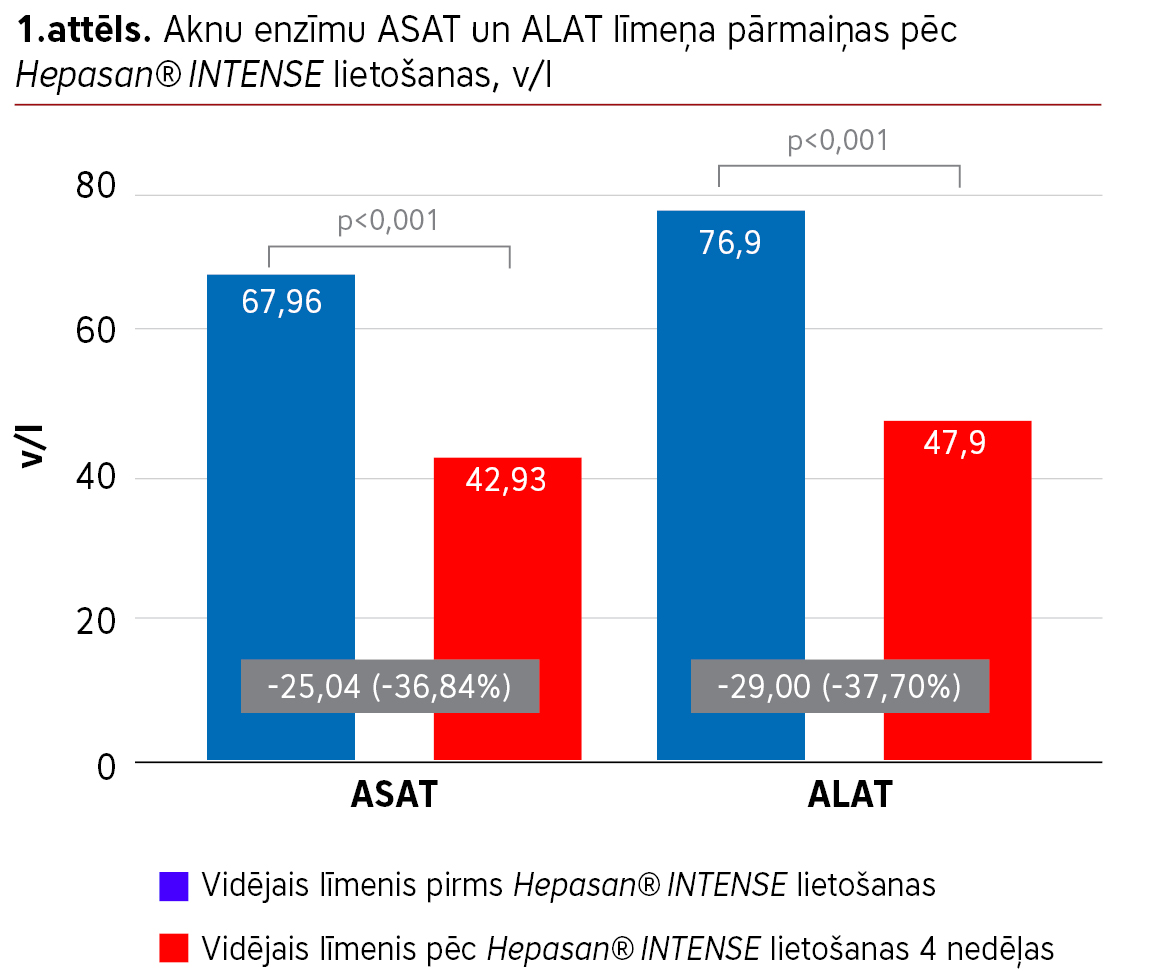
Salīdzinot iegūto asins analīžu rezultātus pirms Hepasan® INTENSE lietošanas un pēc četru nedēļu lietošanas, konstatētas statistiski būtiskas atšķirības ASAT un ALAT rādītājos.
Vidējais ASAT līmenis pirms Hepasan® INTENSE lietošanas bija 67,96 v/l, bet pēc tā lietošanas 42,93 v/l, ASAT līmenis pazeminājās par 25,04 v/l jeb 36,84% (p<0,001). Vidējais ALAT līmenis pirms Hepasan® INTENSE lietošanas bija 76,90 v/l, pēc lietošanas 47,90 v/l, ALAT līmenis pazeminājās par 29,00 v/l jeb 37,70% (p<0,001) (sk. 1. att.).
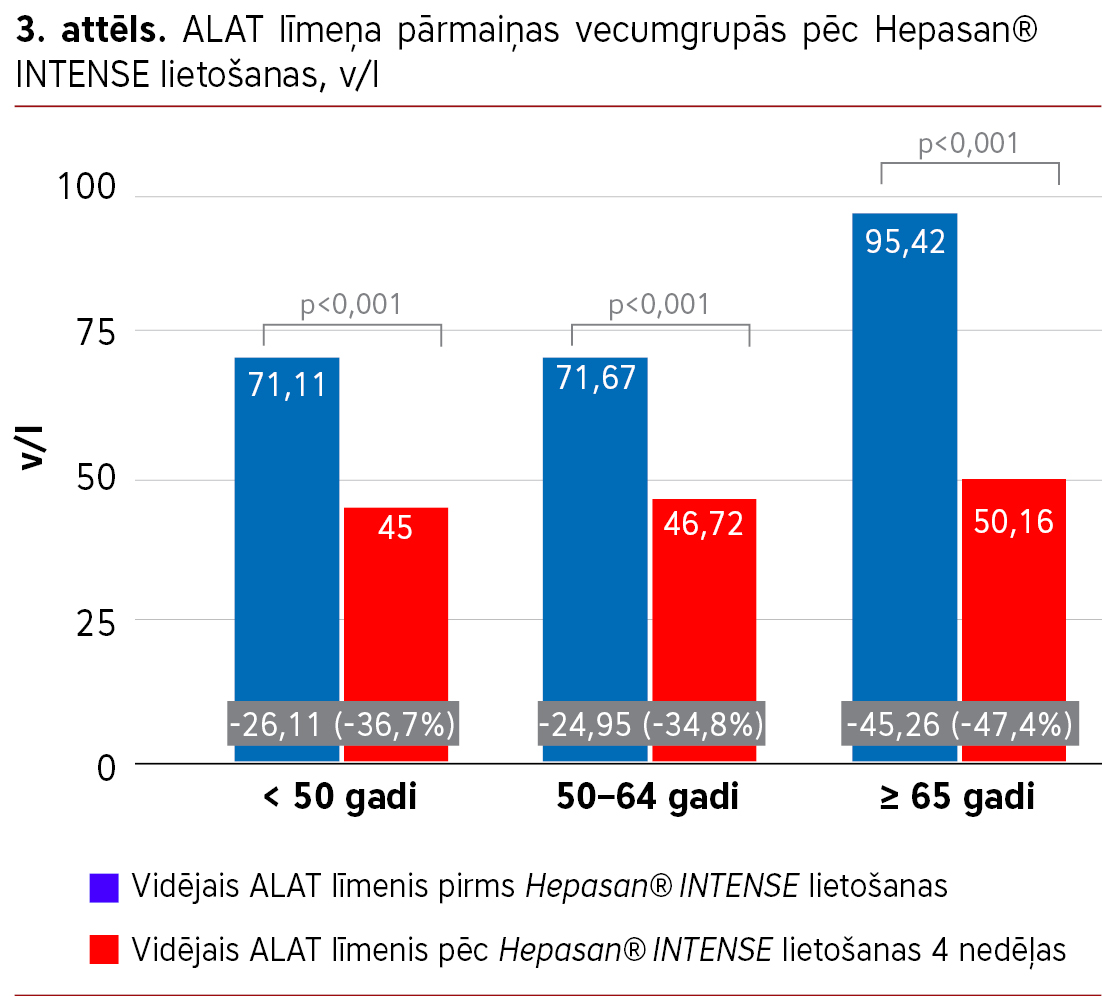
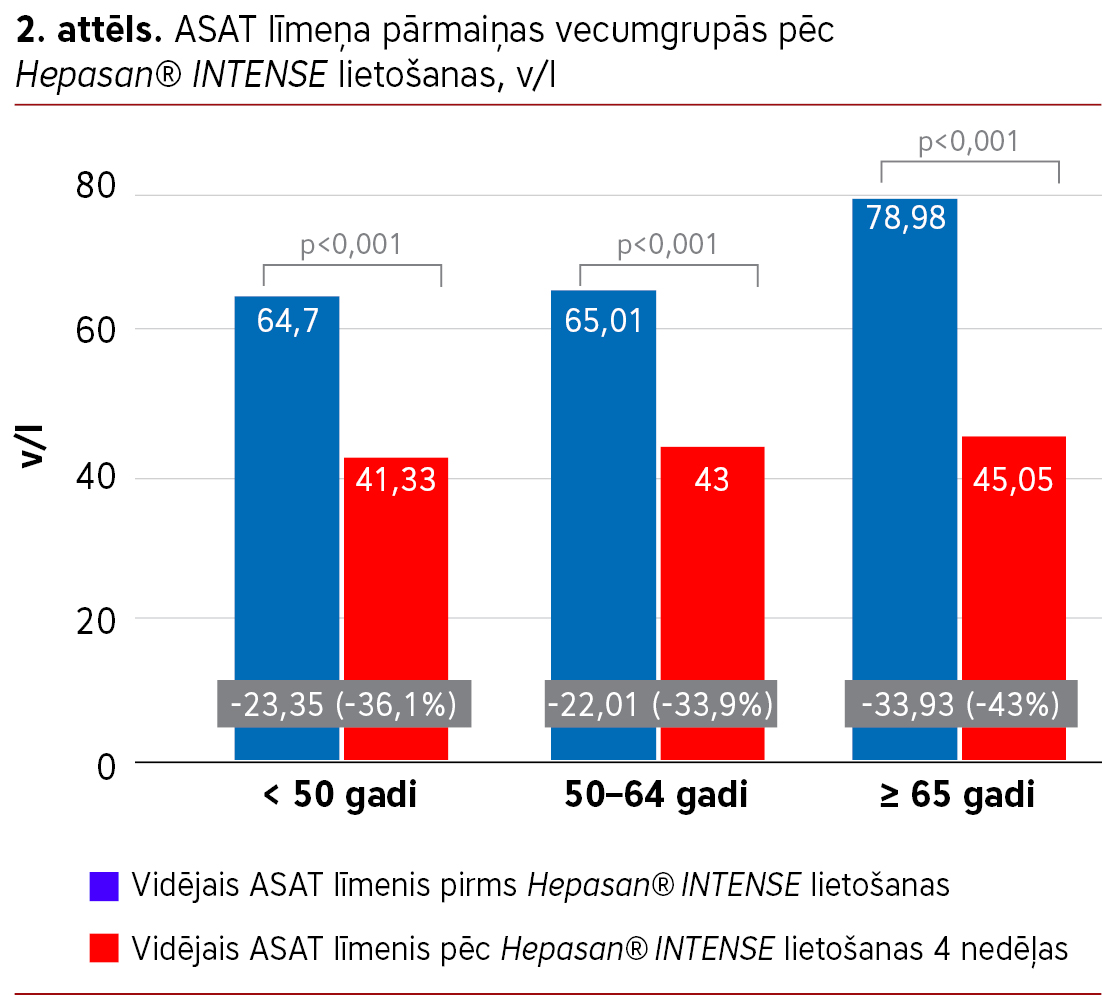
Visās vecumgrupās (<50, 50–64 un ≥65 gadi) tika novērots statistiski nozīmīgs ASAT (sk. 2. att.) un ALAT (sk. 3. att.) līmeņa samazinājums (sapārots Wilcoxon tests, visos gadījumos p<0,001). Lai gan vecākajā grupā samazinājums bija izteiktāks, statistiski nozīmīgas atšķirības starp vecumgrupām netika konstatētas (Kruskal-Wallis tests: ASAT p=0,31; ALAT p=0,15).
Ķermeņa masas indekss (ĶMI)
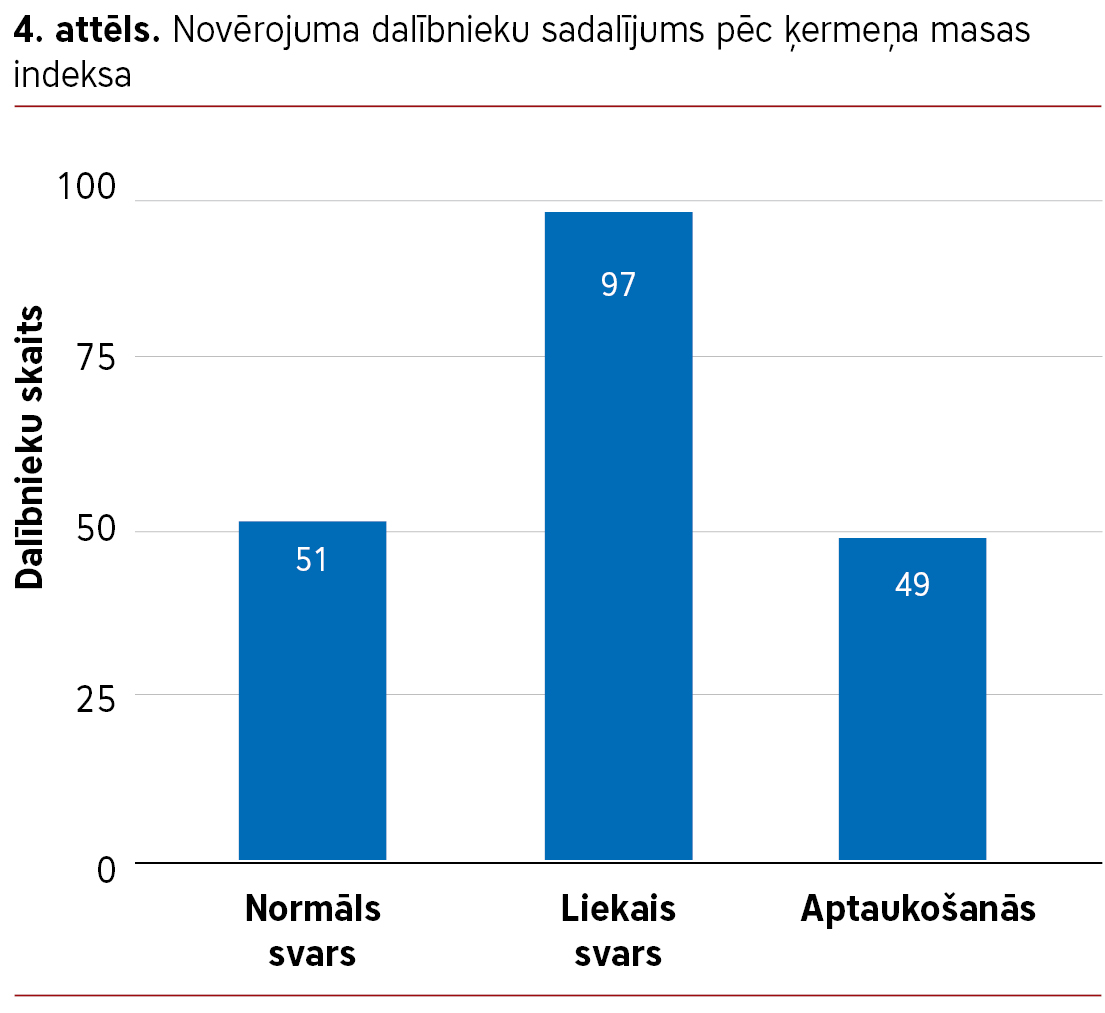
Lielākajai daļai novērojuma dalībnieku bija liekā masa vai aptaukošanās. Normāls ĶMI konstatēts 25,9% dalībnieku, savukārt 49,2% bija liekā masa un 24,9% – aptaukošanās (sk. 4. att.).
Spearman korelācijas analīze parādīja vāju, bet statistiski nozīmīgu pozitīvu saistību starp ĶMI un ALAT līmeni pirms Hepasan® INTENSE lietošanas (ρ≈0,20; p<0,01), savukārt saistība starp ĶMI un ASAT līmeni bija vāja un statistiski nenozīmīga (ρ≈0,10; p>0,05).
Novērojuma dalībnieku vidējais ĶMI bija 28,0±4,9 kg/m², kas atbilst liekas masas kategorijai. ĶMI mediāna bija 27,1 (IQR 25,0–29,8), parādot, ka vismaz puse dalībnieku bija liekā masa vai I pakāpes aptaukošanās. ĶMI vērtību diapazons bija plašs (18,8–59,4 kg/m²), ietverot gan normālu ķermeņa masu, gan smagu (III pakāpes) aptaukošanos, kas liecina par heterogēnisku novērojuma populāciju.
ASAT un ALAT līmeņa samazinājums tika novērots visās ĶMI grupās (<25, 25–29,9 un ≥30 kg/m²). Lielākais ASAT un ALAT samazinājums konstatēts dalībniekiem ar lieko masu (ĶMI 25–29,9 kg/m²), tomēr starp ĶMI grupām statistiski nozīmīgas atšķirības netika konstatētas (Kruskal–Wallis tests: ASAT p=0,062; ALAT p=0,235).
Secinājumi
Četru nedēļu ilga dabiska preparāta Hepasan® INTENSE lietošana bija saistīta ar statistiski nozīmīgu aknu enzīmu ASAT un ALAT līmeņa samazinājumu novērojuma dalībniekiem ar sākotnēji paaugstinātiem rādītājiem. Vidēji ASAT līmenis samazinājās par 36,84%, bet ALAT – par 37,70% (abos gadījumos p<0,001).
Statistiski nozīmīgs ASAT un ALAT līmeņa samazinājums tika novērots visās analizētajās vecumgrupās (<50, 50–64 un ≥65 gadi), un netika konstatētas statistiski nozīmīgas atšķirības starp vecumgrupām, kas liecina par līdzīgu enzīmu līmeņa pārmaiņu raksturu dažādās vecumgrupās.
Novērojuma populācijā dominēja dalībnieki ar lieko masu vai aptaukošanos, un vidējais ĶMI atbilda liekas masas kategorijai. ASAT un ALAT līmeņa samazinājums tika novērots visās ĶMI grupās (<25, 25–29,9 un ≥30 kg/m²), savukārt starp ĶMI grupām statistiski nozīmīgas enzīmu līmeņa samazināšanās atšķirības netika konstatētas.
Konstatēta statistiski nozīmīga pozitīva saistība starp ĶMI un ALAT līmeni pirms Hepasan® INTENSE lietošanas, savukārt saistība starp ĶMI un ASAT līmeni nebija statistiski nozīmīga. Novērojuma rezultāti liecina, ka enzīmu līmeņa samazinājuma apmērs galvenokārt bija saistīts ar sākotnējo ASAT un ALAT līmeni, nevis ar vecumu vai ĶMI.
Kopumā Hepasan® INTENSE var uzskatīt par noderīgu papildinājumu pacientiem ar paaugstinātu aknu enzīmu ASAT un ALAT līmeni neatkarīgi no vecuma un ĶMI.
Santa Rubīna, sertificēta farmaceite
Vēres
1. Pearce, L. (2016). Non-alcoholic fatty liver disease. Nursing Standard, 30(52), 15.
2. Hansen, C. D., Lindvig, K. P., Grønbæk, H., et.al. (2024). New nomenclature for fatty liver disease. Ugeskrift for Læger, 186(19), V12230778.
3. Brunt, E., Wong, V. S., Nobili, V., et al. (2015). Nonalcoholic fatty liver disease. Nature Reviews Disease Primers, 1, 15080.
4. Avalos Q, B. E., Valdes, M., Aggarwal, P., et.al. (2023). Non‑alcoholic fatty liver disease: Current concepts of a silent, but potentially reversible disorder. Advances in Research in Gastroenterology & Hepatology, 19 (4), 556019.
5. Pivtorak, K. V., Yakovleva, O. O., Pashinskyi, Y. M., et.al. (2022). Difficulties in diagnosis of alcoholic fatty liver disease and metabolically associated fatty liver disease. Reports of Vinnytsia National Medical University, 26 (2), 335–338.
6. Koplay, M., Sivri, M., Erdogan, H., Nayman, A. (2015). Importance of imaging and recent developments in diagnosis of nonalcoholic fatty liver disease. World Journal of Hepatology, 7(5), 769–776.
7. AlShaalan, R., Aljiffry, M., Al-Busafi, S., et.al. (2015). Nonalcoholic fatty liver disease: Noninvasive methods of diagnosing hepatic steatosis. Saudi Journal of Gastroenterology, 21(2), 64–70.
8. Berger, D., Desai, V., Janardhan, S. (2019). Con: Liver biopsy remains the gold standard to evaluate fibrosis in patients with nonalcoholic fatty liver disease. Clinical Liver Disease (Hoboken), 13(4), 114–116.
9. Benedict, M., Zhang, X. (2017). Non-alcoholic fatty liver disease: An expanded review. World Journal of Hepatology, 9(16), 715–732.
10. Khan, A., Ali, S., Usman ul Haq, M., et.al. (2021). Relationship between alanine and aspartate transaminases (ALT and AST) and fatty liver on ultrasound. Pakistan Journal of Medical & Health Sciences, 15(7), 1610–1613.
11. Slimību profilakses un kontroles centrs. Ķermeņa masas indekss. E-veselība.
12. Eurostat. (2024). Share of overweight people aged 16 years or over, 2022 (%) [Infographic]. European Commission.
13. Liu, J., Ayada, I., Zhang, X., et.al. (2022). Estimating global prevalence of metabolic dysfunction-associated fatty liver disease in overweight or obese adults. Clinical Gastroenterology and Hepatology, 20(3), e573–e582.
14. Vulchi, J., Suryadevara, V., Mohan, P., et al. (2023). Obesity and metabolic dysfunction-associated fatty liver disease: Understanding the intricate link. Journal of Translational Gastroenterology, 1(2), 74–86.
15. Féher, J., Lengyel, G. (2012). Silymarin in the prevention and treatment of liver diseases and primary liver cancer. Current Pharmaceutical Biotechnology, 13(1), 210–217.
16. Malik, A., Malik, M., Qureshi, S. (2024). Effects of silymarin use on liver enzymes and metabolic factors in metabolic dysfunction-associated steatotic liver disease: A systematic review and meta-analysis. Canadian Liver Journal, 7(1), 40–53.
17. Kenny, T.C., Scharenberg, S., Abu-Remaileh, M., Birsoy, K. (2025). Cellular and organismal function of choline metabolism. Nature metabolism.
18. Hollenbeck, C.B. (2012). An introduction to the nutrition and metabolism of choline. Central nervous system agents in medicinal chemistry, 12 2, 100-13.
19. Zeisel, S.H., Blusztajn, J.K. (1994). Choline and human nutrition. Annual review of nutrition, 14, 269-96
20. Saeed, M., Alagawany, M., Arain, M. A., et.al. (2017). Beneficial impacts of choline in animal and human with special reference to its role against fatty liver syndrome. Journal of Experimental Biology and Agricultural Sciences, 5(5), 589–598.
21. Corbin, K.D., Zeisel, S.H. (2012). Choline metabolism provides novel insights into nonalcoholic fatty liver disease and its progression. Current Opinion in Gastroenterology, 28, 159–165.
22. Yu, D., Shu, X.-O., Xiang, Y.-B., Li, H., et.al. (2014). Higher dietary choline intake is associated with lower risk of nonalcoholic fatty liver in normal-weight Chinese women. Journal of Nutrition, 144(12), 2034–2040.
23. Abenavoli, L., Myazin, R.G., Fagoone, S., et.al. (2022). Treatment with phosphatidylcholine of patients with non-alcoholic fatty liver disease: a prospective pilot study. Minerva Gastroenterology.
24. Li, Z., Wang, F., Liang, B., et al. (2020). Methionine metabolism in chronic liver diseases: An update on molecular mechanism and therapeutic implication. Signal Transduction and Targeted Therapy, 5, 280.
25. Lieber, C.S. (2002). S-adenosyl-L-methionine: its role in the treatment of liver disorders. The American journal of clinical nutrition, 76 5, 1183S-7S.
26. Mora, S.I., Garcia-Roman, J., Gómez-Ñañez, I., Garcia-Roman, R. (2018). Chronic liver diseases and the potential use of S-adenosyl-L-methionine as a hepatoprotector. European Journal of Gastroenterology & Hepatology.
27. Ma, H., Liu, H., Yang, Y., et.al. (2024). The effect of folate deficiency and different doses of folic acid supplementation on liver diseases. British Journal of Nutrition, 133, 37-47.
28. Chan, C. W., Chan, P. H., Lin, B. F. (2022). Folate deficiency increased lipid accumulation and leptin production of adipocytes. Frontiers in Nutrition, 9, 852451.
29. Asbaghi, O., Ashtary-Larky, D., Bagheri, R., et al. (2021). Folic acid supplementation improves glycemic control for diabetes prevention and management: A systematic review and dose-response meta-analysis of randomized controlled trials. Nutrients, 13(7), 2355.
30. Asbaghi, O., Ashtary-Larky, D., Bagheri, R., et al. (2022). Beneficial effects of folic acid supplementation on lipid markers in adults: A GRADE-assessed systematic review and dose-response meta-analysis of data from 21,787 participants in 34 randomized controlled trials. Critical Reviews in Food Science and Nutrition, 62(30), 8435–8453.
31. Isoda, K., Kagaya, N., Akamatsu, S., et.al. (2008). Hepatoprotective effect of vitamin B12 on dimethylnitrosamine-induced liver injury. Biological & pharmaceutical bulletin, 31 2, 309-11.
32. Sharma, C., Badyal, A. (2021). Association between vitamin B12 and non-alcoholic fatty liver disease: a case control study in Katra Jammu. International Journal of Bbasic and clinical pharmacology, 10, 726.

 Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju
Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju