Ņemot vērā pieaugošo jautājumu un pieprasījumu skaitu par SARS-CoV-2 (Covid-19) testiem un to atbilstību, Veselības inspekcija (VI) informē SARS-CoV-2 ātro antigēnu testu izplatītājus un patērētājus par Eiropas Komisijas izstrādātiem ieteikumiem 2020/1743 (2020. gada 18. novembris) par ātro antigēna testu izmantošanu, lai diagnosticētu SARS-CoV-2 infekciju.
Pamatojoties uz ieteikumos minēto, testu laišanu tirgū reglamentē Eiropas Parlamenta un Padomes Direktīva 98/79/EK (1998. gada 27. oktobris) par medicīnas ierīcēm, ko lieto in vitro diagnostikā. VI vērš uzmanību, ka Direktīvas 98/79 prasības ir pārņemtas ar Ministru kabineta 2017. gada 28. novembra noteikumiem Nr. 689 “Medicīnisko ierīču reģistrācijas, atbilstības novērtēšanas, izplatīšanas, ekspluatācijas un tehniskās uzraudzības kārtība”. Noteikumi Nr.689 nosaka, ka ražotājs pirms medicīnas ierīces laišanas brīvā apgrozībā izdod EK atbilstības deklarāciju un norāda medicīnas ierīces atbilstību attiecināmajām prasībām un tās klasi. Atkarībā no ražotāja paredzētā testa lietošanas nolūka, tie ir klasificējami kā pašpārbaudes (selft-testing) vai citas (other) in vitro diagnostikas medicīnas ierīces.
Lai pārliecinātos par in vitro diagnostikas medicīnas ierīces atbilstību prasībām, ir nepieciešami sekojoši dokumenti:
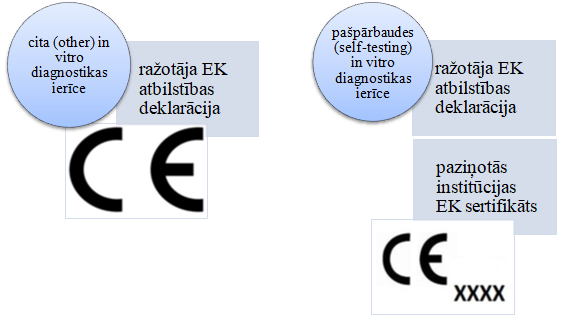
VI norāda, ka in vitro diagnostikas medicīnas ierīcēm, kas klasificētas kā citas (other), ir jābūt marķētām ar CE atbilstības marķējumu, savukārt pašpārbaudes (self-testing) in vitro diagnostikas medicīnas ierīcēm ir jābūt marķētām ar CE atbilstības marķējumu, kur pie CE marķējuma ir norādīts paziņotās institūcijas identifikācijas kods.
Pirms testu iegādes un lietošanas iesakām iepazīties ar ražotāja norādījumiem lietošanas instrukcijā – noskaidrojot kādam mērķim tests paredzēts un kas to drīkst lietot. Inspekcija, izvērtējot dažādu testu ražotāju lietošanas instrukcijas, konstatēja, ka testi, kas klasificēti kā cita (other) in vitro diagnostikas medicīnas ierīce, paredzēti profesionālai lietošanai. Testu lietošanas instrukcijā ražotājs parasti norāda, ka pēc testa veikšanas ir jāveic papildu izmeklējumi, lai apstiprinātu testā iegūto diagnozi.
Vairāk informācijas par Eiropas Komisijas izstrādātiem ieteikumiem 2020/1743 (2020. gada 18. novembris) par ātro antigēna testu izmantošanu, lai diagnosticētu SARS-CoV-2 infekciju – Eiropas Komisijas tīmekļvietnē: https://eur-lex.europa.eu/legal-content/LV/TXT/PDF/?uri=CELEX:32020H1743&from=EN
Papildus VI informē par Eiropas Komisijas izstrādātu SARS-CoV-2 testu datubāzi (COVID-19 In Vitro Diagnostic Medical Devices), kurā tiek apkopota informācija par Eiropas Savienībā pieejamiem SARS-CoV-2 testiem. Datubāzi iespējams aplūkot, apmeklējot tīmekļvietni: https://covid-19-diagnostics.jrc.ec.europa.eu/devices
Informācija par Latvijas Republikā izplatītiem SARS-CoV-2 pašpārbaudes testiem ir pieejama LATMED reģistrā (https://latmed.zva.gov.lv/public/pazinojumuKatalogs.aspx). Noteikumi Nr.689 paredz, ka paziņošanas procedūra Zāļu valsts aģentūrā ir jāveic izplatītājiem/importētājiem, kas izplata Latvijas Republikas tirgū pašpārbaudes in vitro diagnostikas medicīnas ierīces, savukārt par citu (other) in vitro diagnostikas medicīnas ierīču izplatīšanu paziņošana nav jāveic, līdz ar to LATMED reģistrā netiek reģistrēti dati par Testiem, kas pieder pie kategorijas “citi” (others).
Jautājumu gadījumā VI iesaka sazināties ar Medicīnisko ierīču uzraudzības nodaļu telefoniski +371 67081611 vai izmantojot e-pasta adresi miun@vi.gov.lv.

 Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju
Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju