EMA (Eiropas Zāļu aģentūra) sākusi vērtēt “Taw Pharma” iesniegto pieteikumu deksametazona reģistrācijai COVID-19 infekcijas ārstēšanai pieaugušiem pacientiem, kas atrodas stacionārā. “Taw Pharma” iesniegto pieteikumu izvērtēs EMA Cilvēkiem paredzēto zāļu komiteja (CHMP) saskaņā ar paātrinātās vērtēšanas termiņiem. Tas ļaus CHMP sniegt slēdzienu par “Taw Pharma” deksametazona guvumiem un riskiem pēc iespējas īsākā laika periodā. 2020. gada jūlijā publicētie RECOVERY pētījuma rezultāti ... Lasīt tālāk »
Medikamenti
Onkologi aicina palielināt valsts apmaksāto personalizēto biomarķieru testu skaitu
Latvijas vadošie onkologi un nozares pārstāvji vēstulē veselības ministrei Ilzei Viņķelei un Saeimas deputātiem aicina palielināt valsts apmaksāto personalizēto biomarķieru testu skaitu, kas vajadzīgi mērķētas terapijas nozīmēšanai onkoloģisko slimību pacientiem. “Šobrīd katastrofāli zemais testēšanas apjoms bremzē audzēju sekmīgu ārstēšanu, un lielai daļai pacientu netiek nozīmēta viņu individuālajam gadījumam atbilstoša terapija. Rezultātā pacienta ārstēšana nav efektīva, ja vien pacients pats nav ... Lasīt tālāk »
Oksfordas Universitāte un “AstraZeneca” atsāk Covid-19 vakcīnas klīniskos pētījumus
Oksfordas Universitāte un farmācijas firma “AstraZeneca” atsākušas Covid-19 vakcīnas klīniskos izmēģinājumus, kas bija pārtraukti vairākas dienas, jo kādam brīvprātīgajam, kas piedalījās izmēģinājumos, bija parādījušās blaknes. Izmēģinājumi atsākušies pēc tam, kad saņemta Lielbritānijas Zāļu un veselības aprūpes produktu regulēšanas aģentūras piekrišana, norādīts Oksfordas Universitātes sestdien izplatītajā paziņojumā. Pētījumu atsākšana ir “labas ziņas ikvienam”, tviterī ierakstījis Lielbritānijas veselības ministrs Mats Hankoks. Tādu ... Lasīt tālāk »
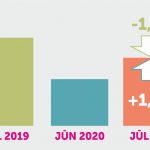
Zāļu lieltirgotavu realizācija jūlijā Latvijā samazinājusies par 1,3%
Zāļu lieltirgotavas šogad jūlijā Latvijā realizējušas zāles 31,56 miljonu eiro apmērā ar pievienotās vērtības nodokli (PVN), kas ir par 1,3% mazāk nekā 2019.gada attiecīgajā periodā, liecina Zāļu valsts aģentūras dati. Savukārt salīdzinājumā ar iepriekšējo mēnesi – jūniju – zāļu realizācijas apmērs pieaudzis par 1,4%. 2020.gada jūlijā zāļu lieltirgotavas Latvijā realizējušas kopumā 3,58 miljonus medikamentu iepakojumu. Zāļu valsts aģentūras dati arī ... Lasīt tālāk »
“Grindeks” apgrozījums pirmajā pusgadā pieaudzis par 37%
Zāļu ražotājs “Grindeks” šogad pirmajā pusgadā strādāja ar 94,517 miljonu eiro apgrozījumu, kas ir par 37% vairāk nekā 2019. gada attiecīgā periodā, savukārt koncerna peļņa pieauga par 68,4% un bija 12,867 miljoni eiro. Kompānijas valdes priekšsēdētājs Juris Hmeļņickis atzīmēja, ka 2020.gada pirmajā pusgadā “Grindeks” sasniedza labākos finanšu rezultātus koncerna pastāvēšanas laikā. Hmeļņickis īpaši atzīmē “Grindeks” meitasuzņēmuma “Kalceks” veikumu. 2020. gada ... Lasīt tālāk »
EK iegādājas 30 000 remdesivira devu Covid-19 pacientu ārstēšanai
Eiropas Komisija (EK) parakstījusi līgumu ar ASV farmācijas gigantu “Gilead” par 30 000 pretvīrusa medikamenta remdesivira devu iegādāšanos Covid-19 pacientu ārstēšanai Eiropas Savienībā (ES) un Lielbritānijā, ziņo informācijas aģentūra LETA. 63 miljonus eiro vērtais līgums tiks apmaksāts no ES Ārkārtas atbalsta instrumenta, paziņoja EK. ES veselības komisāre Stella Kirjakidu pavēstīja, ka tas ir “vēl viens svarīgs solis mūsu cīņā šīs ... Lasīt tālāk »
EMA uzsāk vērtēšanu par deksametazona lietošanu pieaugušajiem ar Covid-19 un nepieciešamību pēc elpošanas atbalsta
Eiropas Zāļu aģentūra (EMA) ir sākusi vērtēt rezultātus no RECOVERY pētījuma, kurā hospitalizēti pacienti ar COVID-19 infekciju tika ārstēti ar deksametazonu. Šajā pētījuma daļā tika pētīta deksametazona pievienošanas efektivitāte standarta ārstēšanai pieaugušiem pacientiem, kuri saņēma invazīvu ventilāciju, skābekļa terapiju (piemēram, caur sejas masku) vai nesaņēma skābekli. Invazīvas ventilācijas gadījumā aparāts virza gaisu caur caurulīti, kas ievietota pacienta elpceļos. RECOVERY pētījumā tika fiksēti ... Lasīt tālāk »
Brazīlijā tiek uzsākti Ķīnā izstrādātas Covid-19 vakcīnas pēdējie izmēģinājumi
Brazīlijā otrdien, 21. jūlijā, tika uzsākta Ķīnā izstrādātas Covid-19 vakcīnas pēdējā izmēģinājumu stadija, un brīvprātīgie saņēma pirmās šīs vakcīnas devas, ziņo informācijas aģentūra LETA. Vakcīna, kuru izstrādājusi privāta Ķīnas farmācijas firma “Sinovac Biotech”, kļuva par pasaulē trešo vakcīnu, kurai ir uzsākti 3. fāzes klīniskie pētījumi – liela mēroga izmēģinājumi ar cilvēkiem, kas ir pēdējais solis pirms regulatoru sniegta apstiprinājuma. “Mēs ... Lasīt tālāk »
Pēc Covid-19 pārslimošanas imunitāte pret to var izzust pāris mēnešos
Pirmdien publiskota pētījuma dati liecina, ka pacienti, kas atlabuši no jaunā koronavīrusa, var zaudēt imunitāti pret atkārtotu inficēšanos pāris mēnešu laikā. Eksperti uzskata, ka šim atklājumam var būt nozīmīga ietekme uz to, kā valdības reaģē uz jaunā koronavīrusa pandēmiju, tostarp to, kā tiek finansēti vakcīnu pētījumi. Pirmajā šāda veida pētījumā Londonas Karaliskā koledžas zinātnieki pētīja antivielu līmeņus vairāk nekā 90 ... Lasīt tālāk »
SIFFA aicina izstrādāt plānu ģenētisko marķieru ieviešanai
Onkoloģijas jomas mūsdienīga attīstība Latvijā nav iedomājama bez ģenētisko marķieru plašāka pielietojuma, kas vēža ārstēšanu ļauj veikt efektīvāk ar precīzi piemeklētiem medikamentiem. Tāpēc Starptautisko inovatīvo farmaceitisko firmu asociācija (SIFFA) aicina Veselības ministriju izstrādāt ģenētisko marķieru ieviešanas plānu Latvijas Onkoloģijas centrā, lai viestu skaidrību, kad šis būtiskais pakalpojums būs pieejams mūsu valsts pacientiem. Veselības ministrijā šobrīd tiek apspriests onkoloģijas nozares attīstībai ... Lasīt tālāk »

 Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju
Medikamentu Informācijas Centrs Farmācijas portāls | Viss par farmāciju